Basic paper - Qu’est-ce que l’évaporation
Sommaire
1. Qu’est-ce qu’un évaporateur rotatif ?
Un évaporateur rotatif est un appareil de laboratoire qui permet de séparer deux ou plusieurs substances. Ce processus s’appelle la distillation. Pour comprendre plus exactement ce qu’est un évaporateur rotatif et comment il fonctionne, il faut tout d’abord s’intéresser au phénomène de l’évaporation. Cela implique de comprendre le principe physique sur lequel il est basé.
2. Qu’est-ce que l’évaporation ?
L’évaporation est un processus qui a lieu chaque jour autour de nous sans que nous le remarquions :
- le linge sèche sur le fil parce que l’eau s’évapore dans le tissu.
- Lorsque nous faisons bouillir de l’eau sur la cuisinière, la vapeur d’eau s’échappe de la casserole.
S’évaporer signifie : un liquide, par exemple de l’eau, devient un gaz. Il change donc d’état physique (forme) et passe de l’état liquide à l’état gazeux. Cela peut également être exprimé comme suit : la substance passe de la phase liquide à la phase gazeuse.
Revenons à notre casserole d’eau : si nous nous contentons de mettre la casserole sur la table, au bout d’un long moment il n’y aura plus d’eau. Mais l’eau n’a pas simplement disparu : elle s’est évaporée. L’eau passe donc progressivement de la phase liquide à la phase gazeuse sans que nous intervenions. Pour comprendre comment ça fonctionne, nous devons nous rendre à un niveau que l’œil humain ne peut pas percevoir. Avec l’aide de la loupe de Prof. Hei, nous observons l’eau qui se trouve dans la casserole de plus près :
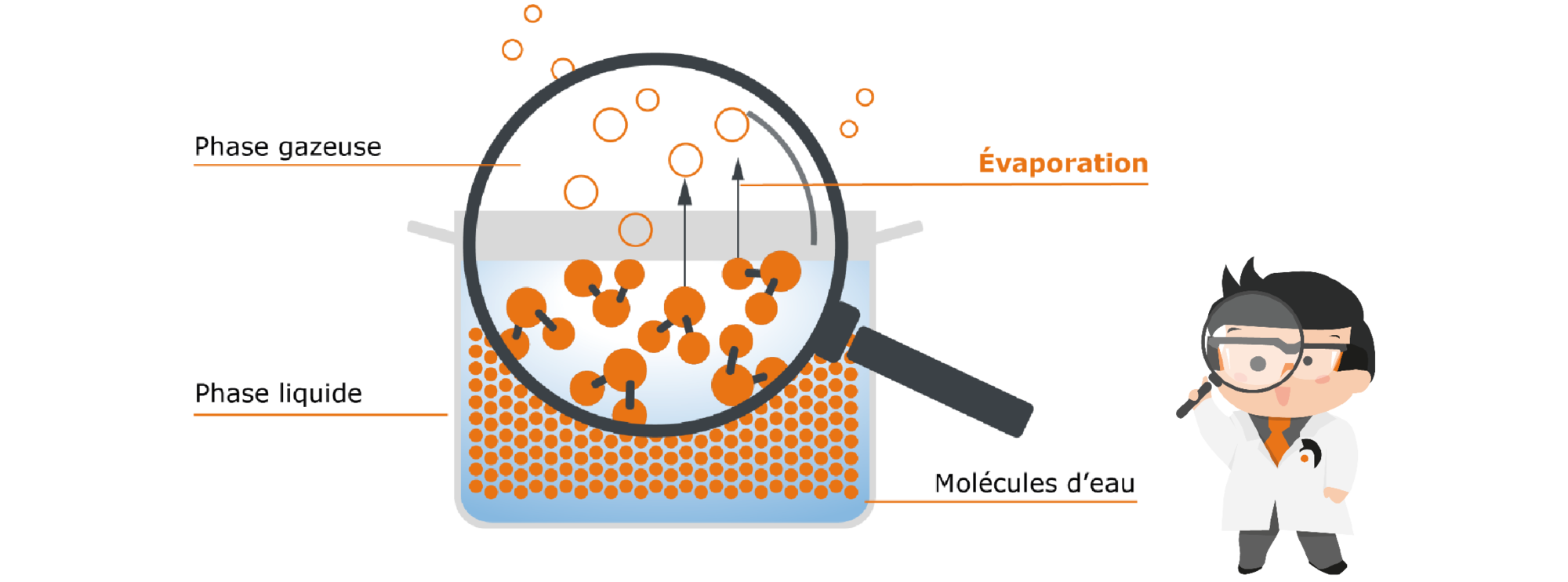
Fig. 1 : casserole sans couvercle remplie d’eau
| Dans l’eau liquide, les molécules d’eau sont très proches les unes des autres et s’accrochent même grâce à des liaisons dites intermoléculaires, donc à des forces de liaison entre les différentes molécules. |  |
| Fig. 2 : molécules d’eau avec liaisons intermoléculaires |
Elles ne sont pas statiques comme des billes dans la casserole, mais sont constamment en mouvement. Ces mouvements provoquent sans cesse des collisions entre les molécules, grâce à quoi l’énergie cinétique est transmise d’une molécule à l’autre. Si une molécule est soumise à un nombre particulièrement élevé de ces collisions, elle a alors l’énergie nécessaire pour rompre les liaisons avec ses molécules partenaires – donc pour se libérer de l’espace réduit du liquide et remonter. Pour la molécule, cette liberté acquise est souhaitable – c’est compréhensible, non ? Qui aime être enfermé ? C’est pourquoi les molécules aspirent toujours à être les plus libres possible – donc, elles passent de la phase liquide à la phase gazeuse dès qu’elles ont suffisamment d’énergie pour le faire.
L’énergie nécessaire pour amener les molécules à la phase gazeuse dépend de leur poids (masse molaire) et des forces de liaisons entre elles. Il en résulte deux grandeurs physiques spécifiques à chaque substance : le point d’ébullition, soit la température à laquelle une substance commence à bouillir (100 °C pour l’eau), et l’enthalpie de vaporisation. Cette dernière indique la quantité d’énergie nécessaire pour évaporer un kilo de la substance concernée. Pour l’eau, cette valeur est de 2 261 kJ/kg, d’autres valeurs sont mentionnées dans le tableau 1.
|
|
Table 1 : masses molaires, points d’ébullition et enthalpies de vaporisation de quelques solvants
| Substance | Masse molaire [g/mol] |
Point d’ébullition [°C] |
Enthalpie de vaporisation [kJ/kg] |
| Toluène | 92,14 | 110 | 413 |
| Eau | 18,02 | 100 | 2.261 |
| Éthanol | 46,07 | 78 | 837 |
| Acétone | 58,08 | 56 | 546 |
| Éther diéthylique | 74,12 | 35 | 392 |
2.1 Que se passe-t-il si nous mettons une casserole d’eau sur une plaque chauffante et la faisons chauffer ?
La chaleur est une forme d’énergie. Grâce à elle, nos molécules peuvent absorber cette énergie devenir beaucoup plus agiles. Les collisions des molécules entre elles augmentent également. Il en résulte que la chaleur amenée fournit à nettement plus de molécules l’énergie nécessaire pour passer de la phase liquide à la phase gazeuse. L’apport de chaleur entraîne donc l’évaporation d’une plus grande quantité d’eau. La quantité de vapeur maximale possible est générée lorsque la température d’ébullition (donc 100 °C pour l’eau) est atteinte.
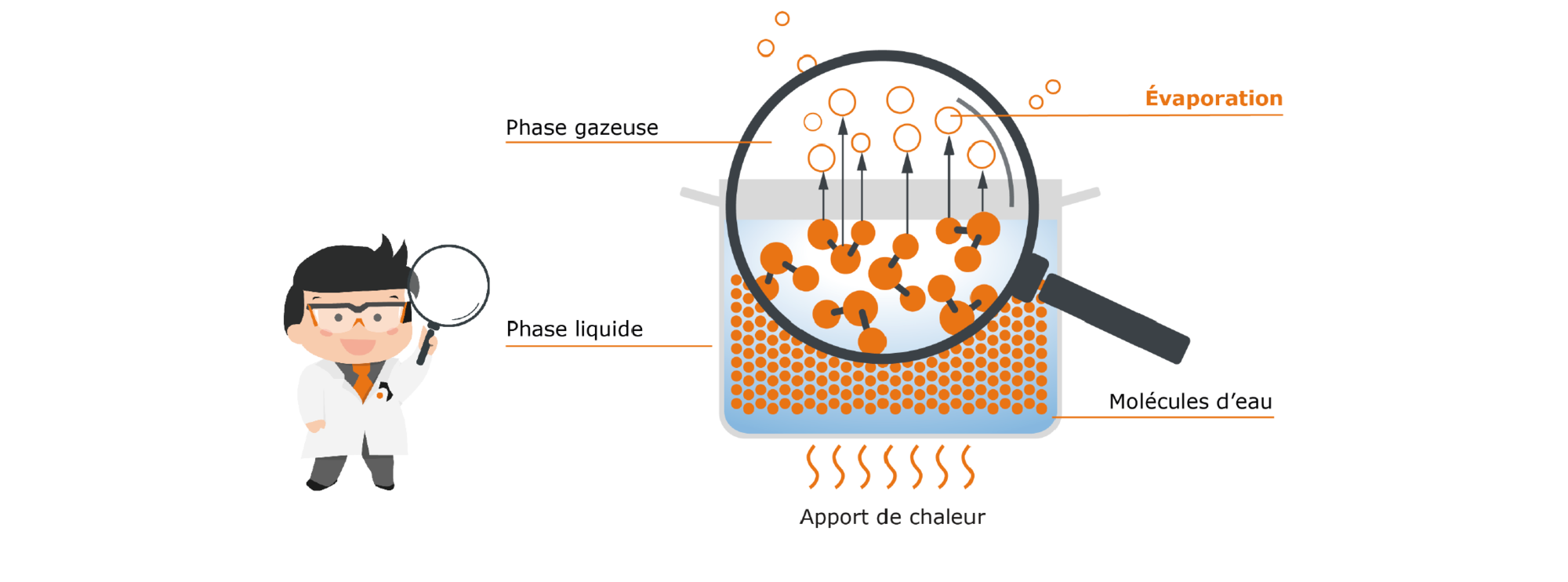
Fig. 3 : casserole sans couvercle remplie d’eau avec apport de chaleur
2.2 Quelle est l’influence de la pression ?
Une autre grandeur que nous n’avons pas encore évoquée jusqu’ici est la pression de l’air : comme tout ce qui nous entoure, notre casserole d’eau est exposée à la pression atmosphérique. Celle-ci varie en fonction de l’altitude, mais est approximativement de 1 000 mbar. Cette pression contrecarre donc le passage de nos molécules d’eau de la phase liquide à la phase gazeuse. Imaginons maintenant que nous réduisions la pression atmosphérique, par ex. de 1 000 mbar à 100 mbar : malgré un apport d’énergie identique, une quantité de molécules nettement plus élevée peut maintenant passer de la phase liquide à la phase gazeuse.
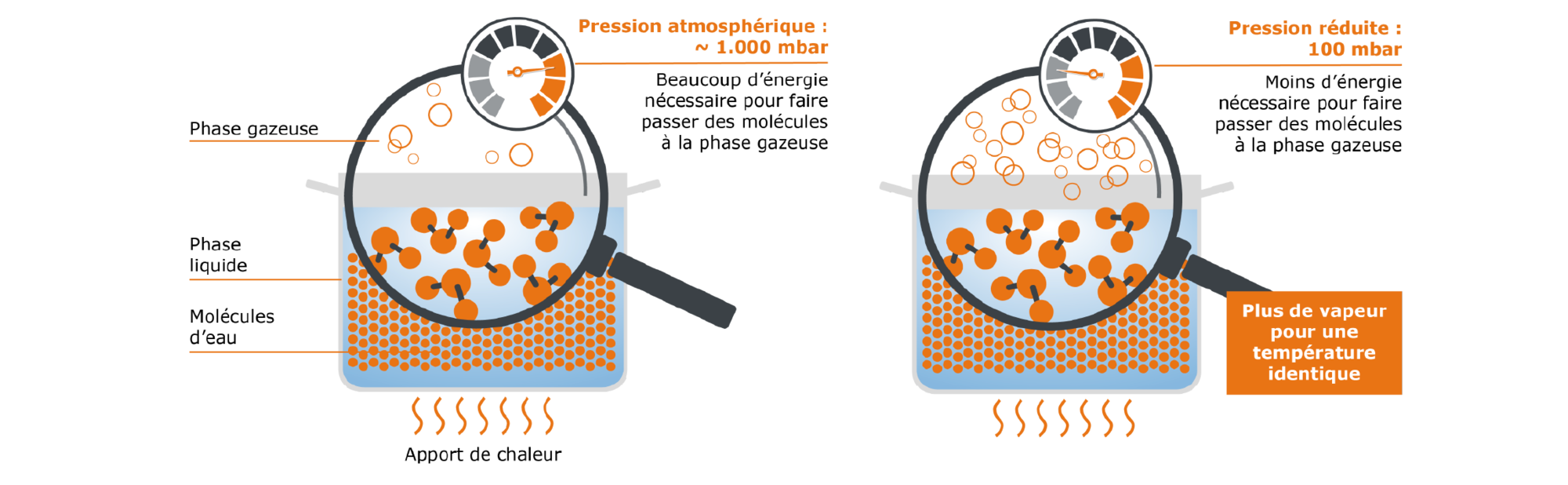
Fig. 4 : influence de la pression sur une casserole sans couvercle remplie d’eau
Nous pouvons en déduire le principe suivant : plus la pression est faible, plus une substance peut s’évaporer facilement et moins il faut de chaleur pour provoquer l’évaporation. La quantité maximale possible de vapeur peut donc être générée à des températures plus faibles (par ex., 50 °C à 100 mbar pour l’eau).

3. Qu’est-ce que la condensation ?
La condensation est pour ainsi dire le processus inverse de l’évaporation : une substance passe de la phase gazeuse à la phase liquide. C’est le cas lorsque nous enlevons à nos molécules d’eau libérées l’énergie que nous leur avions apportée. La méthode la plus simple est d’utiliser le froid.
Pour aborder le phénomène de la condensation, nous reprenons notre exemple de la casserole d’eau : si nous mettons un couvercle sur la casserole, la vapeur ne peut plus simplement s’échapper, mais va rester dans ce système fermé à l’intérieur de la casserole. Mais le couvercle de la casserole est moins chaud que le reste de la casserole : nos molécules d’eau libérées se heurtent donc à cette barrière fraîche et transmettent au couvercle moins chaud une partie de leur énergie. Il y a une compensation de température. Les molécules se rassemblent sur la surface froide et forment des gouttes. Elles se condensent. C’est pourquoi l’eau condensée est également appelée « condensat ». Au bout d’un moment, les gouttes sont suffisamment lourdes et retombent dans le liquide, où elles sont à nouveau alimentées en énergie, ce qui leur permet de monter à nouveau.
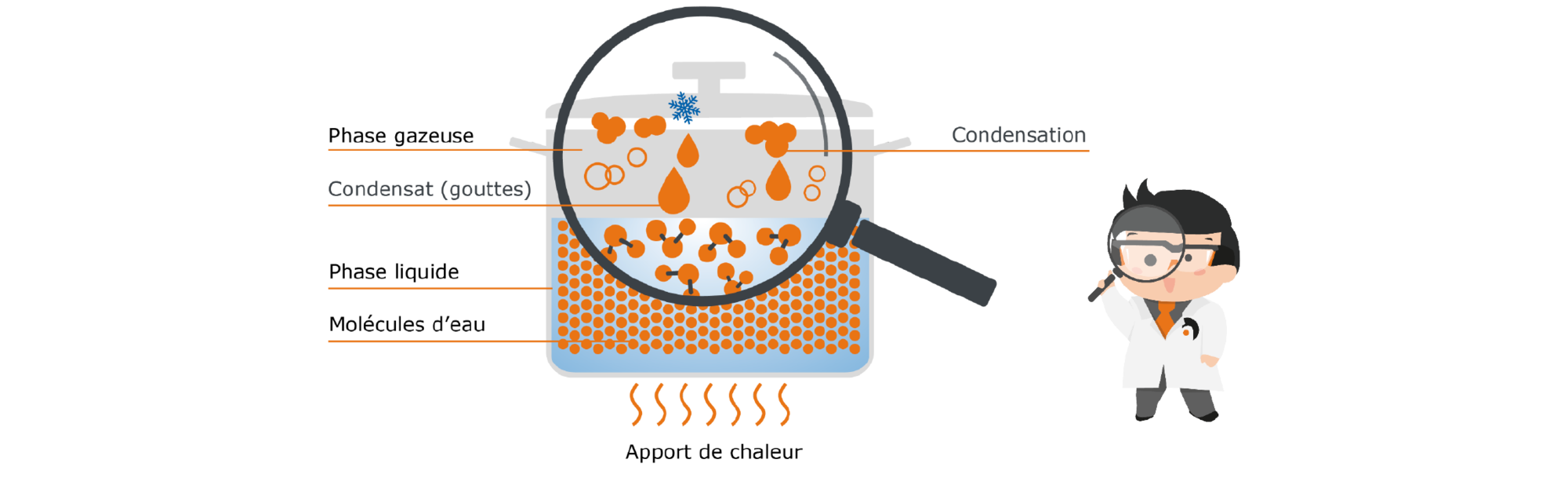
Fig. 5 : condensation dans une casserole couverte
| Un circuit d’évaporation et de condensation équilibré se forme. | 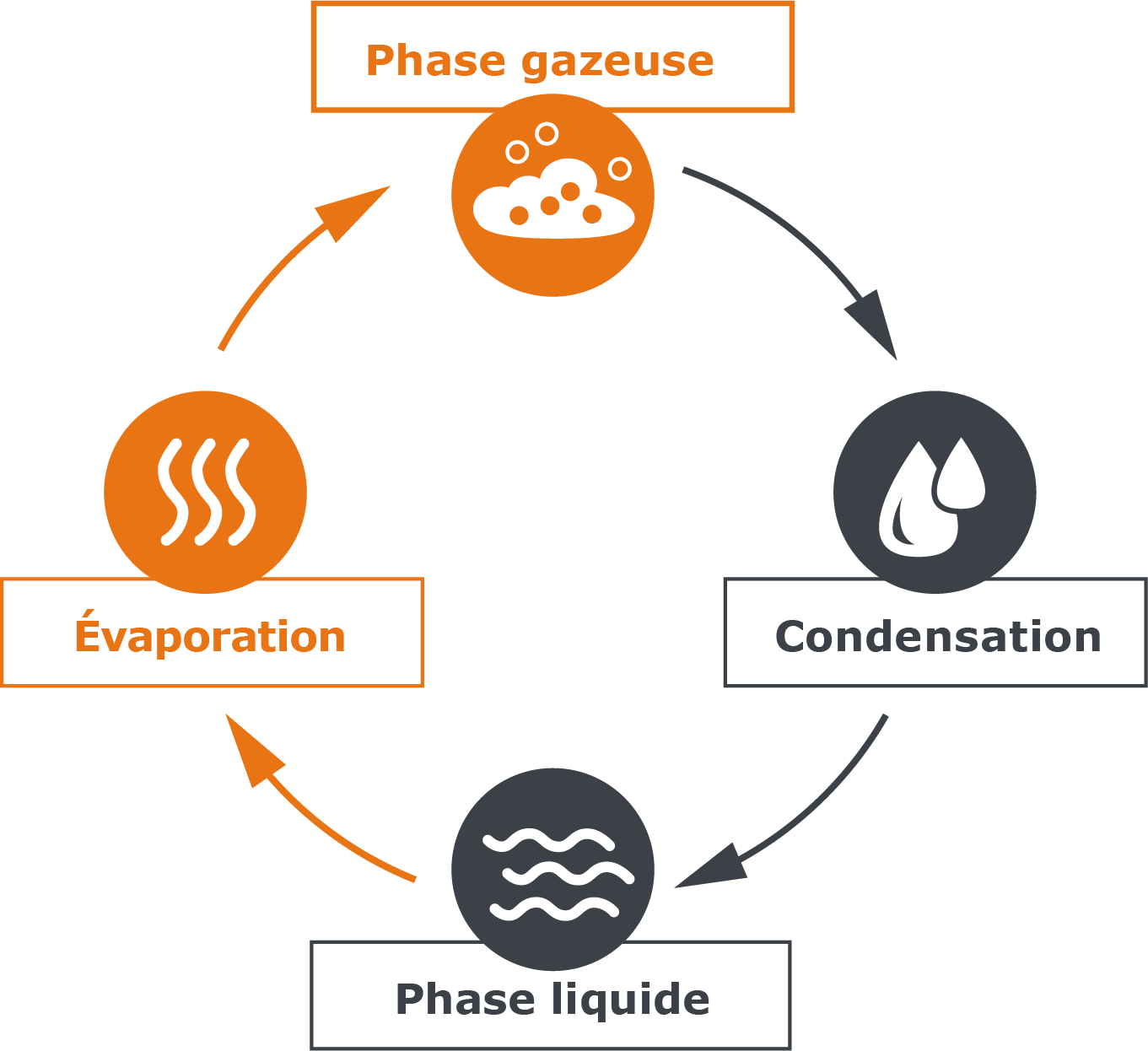 |
| Fig. 6: équilibre entre l’évaporation et la condensation |
4. Qu’est-ce qu’une distillation ?
La distillation est une séparation de substances aux points d’ébullitions différents. Tout d’abord, la substance dont le point d’ébullition est le plus bas est évaporée avant d’être à nouveau condensée à un autre endroit, puis on passe à la substance suivante après avoir augmenté la température et ainsi de suite. En laboratoire, la distillation est une méthode essentielle pour séparer et purifier des substances.
La distillerie statique est un appareil classique permettant d’effectuer cette procédure :
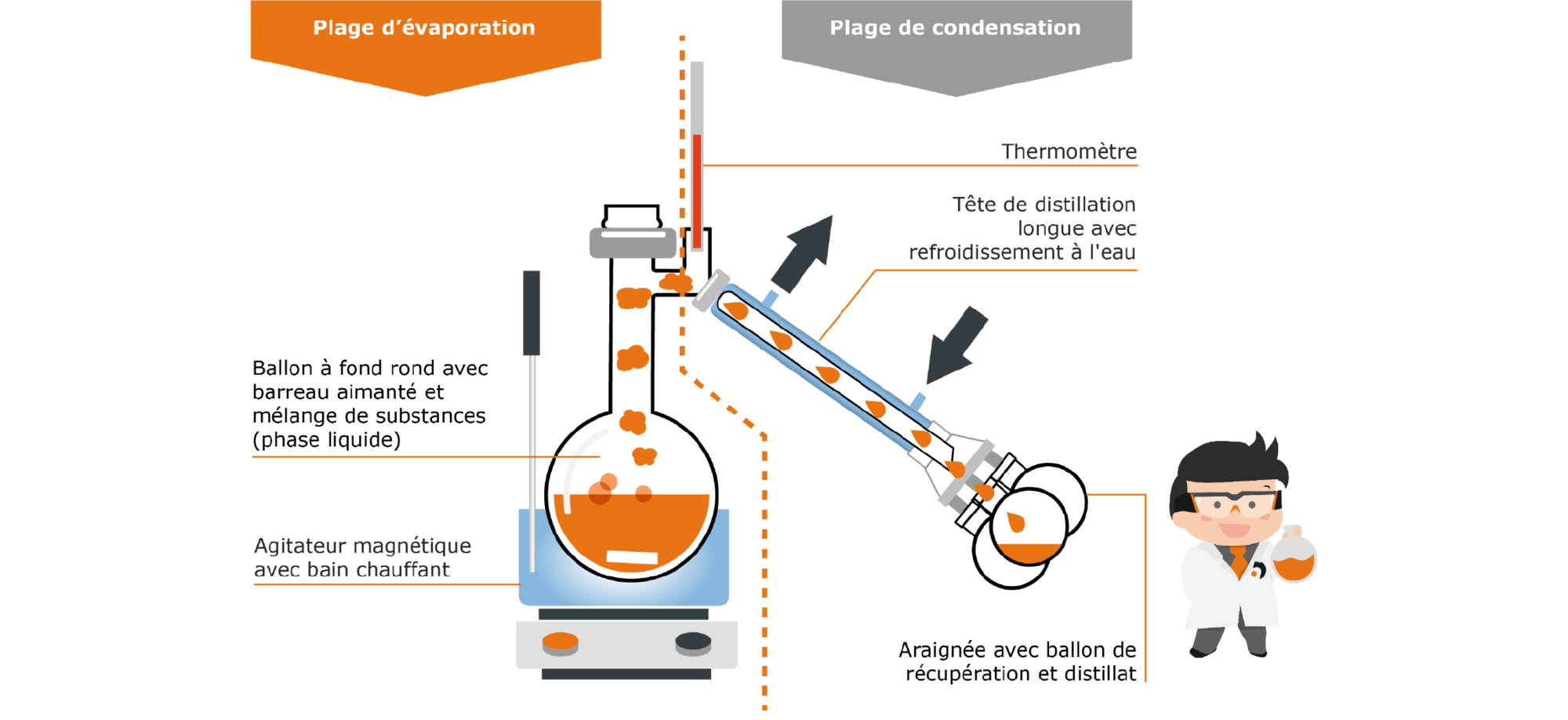
Fig. 7 : structure d’une distillerie statique
L’appareil peut en gros être divisé en deux zones : la zone d’évaporation et la zone de condensation. Dans la zone d’évaporation, un ballon contenant le mélange de substances est réchauffé dans un bain de chauffe. La vapeur de la substance au point d’ébullition le plus faible monte et est guidée dans la zone de condensation, la dite tête de condensation. Elle est refroidie à l’eau, ce qui entraîne la condensation de la vapeur. La tête de condensation étant inclinée vers le bas, les gouttes la traversent et s’écoulent dans le ballon de récupération. Lorsque la première composante (fraction) est entièrement séparée, la dite araignée peut simplement être tournée de telle manière que le prochain ballon de récupération soit en bas et puisse récupérer le distillat. La température du bain de chauffe est augmentée jusqu’à ce que le point d’ébullition du composant suivant (seconde fraction) soit atteint. À la fin de la procédure, les substances séparées pures se trouvent dans les différents ballons de récupération.

Fig. 8 : procédure de distillation avec une distillerie statique
Une distillation peut également être effectuée à une pression réduite en raccordant la distillerie à une pompe à vide : il est ainsi possible de travailler à des températures moins élevées, ce qui constitue en particulier un avantage pour les substances sensibles à la chaleur.
5. Quelle est la différence entre une distillerie statique et un évaporateur rotatif ?
L’évaporateur rotatif est également un appareil de laboratoire utilisé pour séparer des substances par distillation. Il peut également être divisé en deux zones, une pour l’évaporation et une pour la condensation.
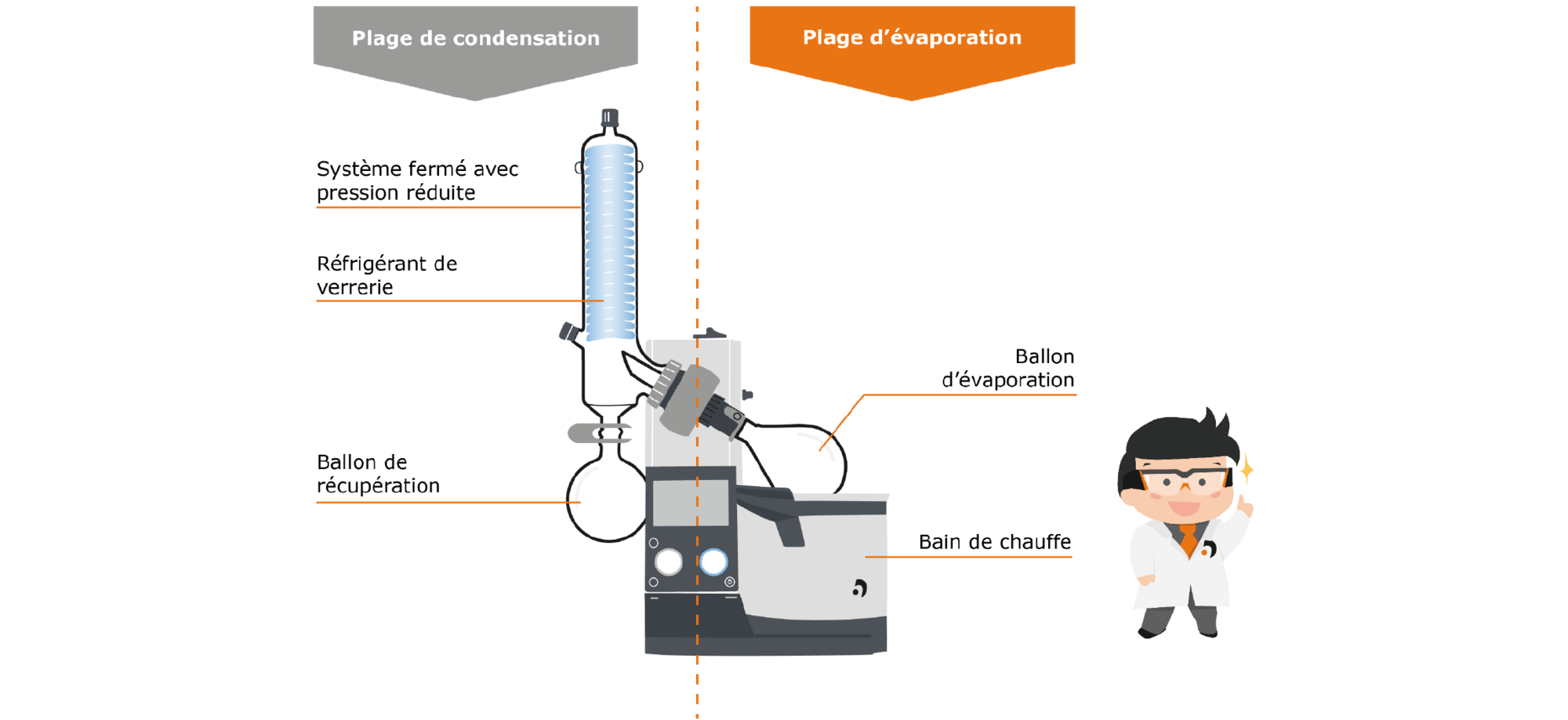
Fig. 9 : structure d’un évaporateur rotatif
Regardons d’abord de plus près la zone d’évaporation : la zone englobe le ballon d’évaporation dans lequel se trouve le milieu liquide. Ce ballon est plongé dans le bain de chauffe, qui apporte l’énergie nécessaire à l’évaporation. Cependant, à la différence de la distillerie liquide, la rotation du ballon est assurée par un moteur. Les effets sont multiples : d’une part, la répartition de la température dans le bain de chauffe et à l’intérieur du ballon est plus homogène, d’autre part, la surface disponible pour l’évaporation est nettement supérieure grâce à la rotation. Ceci a un effet positif sur la vitesse de la procédure d’évaporation et empêche la formation de bulles et d’éclaboussements.
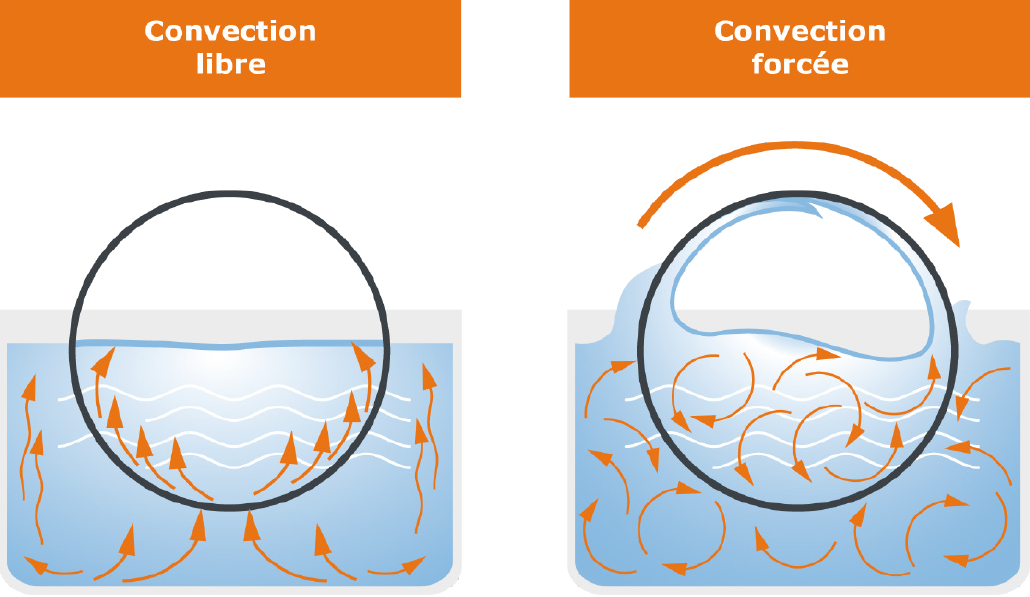
Fig. 10 : comparaison d’un système statique et d’un système rotatif
La vapeur générée monte dans la zone de condensation par la conduite de vapeur : il y a dans cette zone un refroidisseur de verrerie refroidi avec un mélange réfrigérant à la glace carbonique, à l’eau ou au réfrigérant, où la vapeur est condensée et s’écoule dans le ballon de récupération situé plus bas.
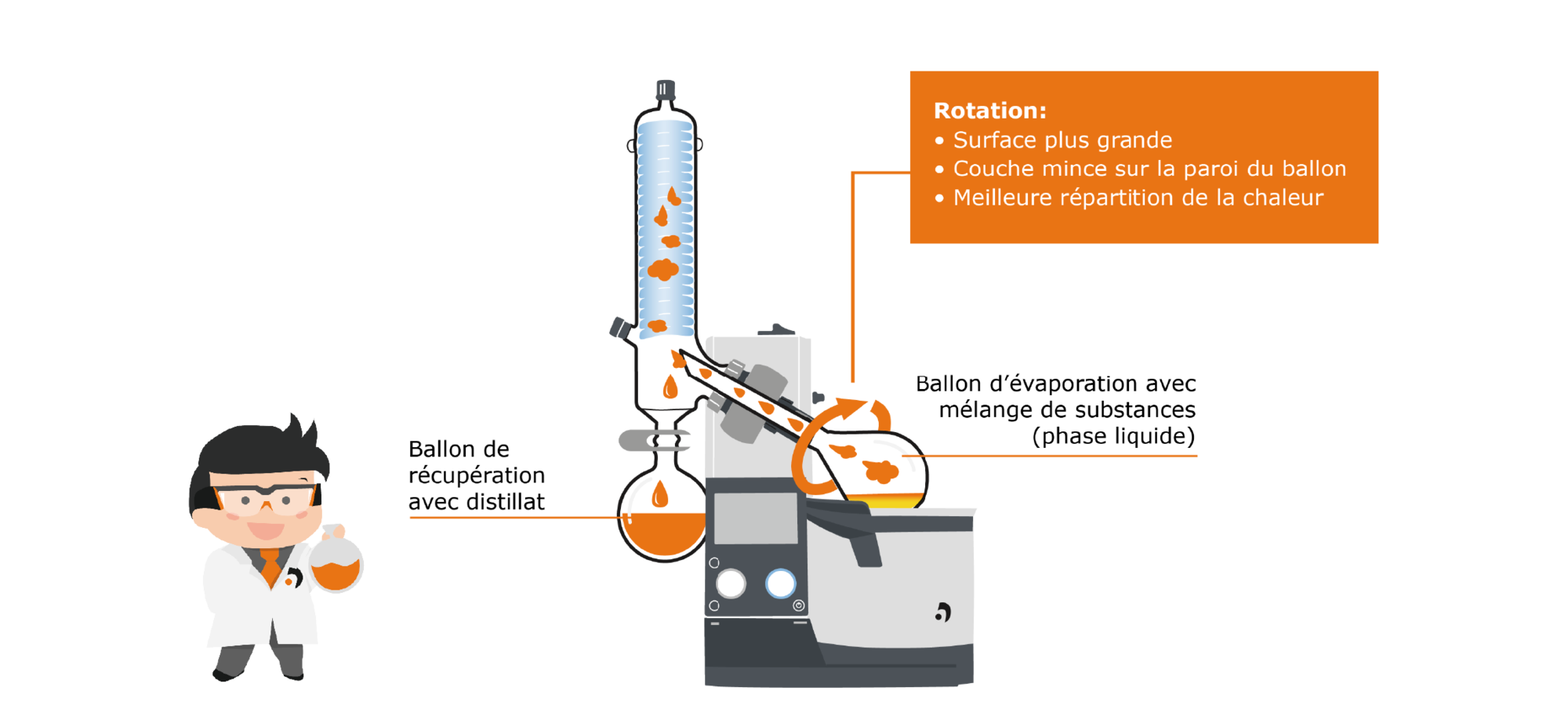
Fig. 11 : processus d’évaporation sur l’évaporateur rotatif
L’ensemble du processus est généralement effectué sous une pression réduite à l’aide d’une pompe à vide afin de profiter des avantages mentionnés plus haut : un apport d’énergie moindre est nécessaire pour déclencher l’évaporation. Les substances sont donc mieux ménagées pendant le traitement. De plus, le fait d’utiliser une pompe à vide permet d’accéder à un paramètre rapidement adaptable pour influencer la vitesse du processus, puisqu’il n’y a pas de temps d’attente longs dus, par exemple, à l’inertie du bain de chauffe.
En raison du trajet court que la vapeur doit parcourir, la performance de séparation d’un évaporateur rotatif est relativement faible : pour obtenir une séparation propre des substances, les points d’ébullition des substances à séparer doivent présenter une différence d’au moins 80 °C.
Téléchargements
|
|